Бензилхлорид
Бензи́лхлори́́д (α-хлоротолуен) — хлороорганічна сполука з формулою .
| Структурна формула | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
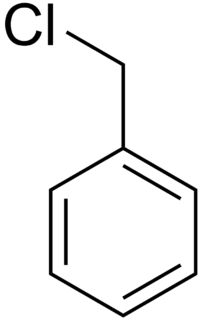
| |||||||||||||||||||||||||
| Загальна інформація | |||||||||||||||||||||||||
| Преференційна назва ІЮПАК | Хлорометилбензен | ||||||||||||||||||||||||
| Систематична назва ІЮПАК | Хлорометилбензен | ||||||||||||||||||||||||
| Інші назви |
Бензилхлорид, α-хлоротолуен | ||||||||||||||||||||||||
| Хімічна формула | C7H7Cl | ||||||||||||||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | ||||||||||||||||||||||||
| Зовнішні ідентифікатори / Бази даних | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Властивості | |||||||||||||||||||||||||
| Молярна маса | 126,59 г/моль [1] | ||||||||||||||||||||||||
| Агрегатний стан |
рідина [1] | ||||||||||||||||||||||||
| Густина |
1,10 г/см3 [1] | ||||||||||||||||||||||||
| Температура плавлення |
-39 °C [1] | ||||||||||||||||||||||||
| Температура кипіння |
179 °C [1] | ||||||||||||||||||||||||
| Температура самозаймання |
585 °C [1] | ||||||||||||||||||||||||
| Розчинність |
0,11 г/л (H2O, 25 °C) [1] | ||||||||||||||||||||||||
| Безпека | |||||||||||||||||||||||||
| Маркування згідно системі УГС
Небезпека | |||||||||||||||||||||||||
| H-фрази | H: H302, H315, H317, H318, H331, H335, H340, H350, H373
| ||||||||||||||||||||||||
| P-фрази | P: P201, P260, P280, P304+P340+P311, P305+P351+P338+P310, P308+P313 | ||||||||||||||||||||||||
| EUH-фрази | EUH: Заходи безпеки відсутні | ||||||||||||||||||||||||
| LD50 |
1230 мг/кг (щур, орально) [1] | ||||||||||||||||||||||||
| Вибухонебезпечність | |||||||||||||||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | |||||||||||||||||||||||||
Фізичні властивості
ред.За стандартних умов є безбарвною рідиною з різким запахом. Важча за воду і погано в ній розчиняється, але добре розчиняється в органічних розчинниках, таких як етанол, хлороформ, ацетон, діетиловий етер та інші.[1][2]
Отримання
ред.Вперше бензихлорид було отримано 1853 року хлоруванням бензилового спирту:[2]
Переважно бензилхлорид отримують хлоруванням толуену. Реакція протікає за вільнорадикальним механізмом:[2]
Хімічні властивості
ред.Заміщення хлору нуклеофілами
ред.Як і інші хлороалкани, вступає у реакції нуклеофільного заміщення. Наприклад, гідролізується гарячою водою та лугами, утворюючи бензиловий спирт:[2]
При реакції з аміаком утворюється бензиламін:[2]
Аналогічна реакція відбувається з амінами. З первинних утворюються вторинні, де другий замісник —бензил, з вторинних третинні, а з тренинних — четвертинні амонієві солі.[2]
Також, при взаємодії з ціанідом натрію утворюється бензилціанід:[2]
Хлорування
ред.Хлорування бензилхлориду призводить до утворення бензалхлориду та бензотрихлориду:[2]
Взаємодія з металами
ред.Реакція Вюрца
ред.Натрій і купрум вступають з бензилхлоридом у реакцію Вюрца, утворюючи дифенілетан:[2]
Реакція з магнієм
ред.При реакції бензилхлориду з магнієм утворюється бензилмагнійхлорид, який використовується для синтезу інших речовин за реакцією Гріньяра.[2][3]
Токсичність
ред.Лакриматор, подразнює очі та слизові оболонки. Є канцерогеном у зв'язку з домішками більш хлорованих сполук.[1]
Джерела
ред.- ↑ а б в г д е ж и к л GESTIS Substance Database. gestis-database.dguv.de. Архів оригіналу за 18 січня 2022. Процитовано 16 січня 2022.
- ↑ а б в г д е ж и к л м Lipper, Karl-August; Löser, Eckhard; Brücher, Oliver (28 липня 2017). Wiley-VCH Verlag GmbH & Co. KGaA (ред.). Benzyl Chloride and Other Side-Chain-Chlorinated Aromatic Hydrocarbons. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. 1—22. doi:10.1002/14356007.o04_o01.pub2. ISBN 978-3-527-30673-2. Архів оригіналу за 16 січня 2022. Процитовано 16 січня 2022.
- ↑ Organic Syntheses Procedure. www.orgsyn.org (англ.). Архів оригіналу за 16 січня 2022. Процитовано 16 січня 2022.



