4-хлоротолуен
4-хлоротолуен (п-хлоротолуен) ― хлорорганічна сполука, похідна толуену з формулою . За стандартних умов і кімнатної температури є безбарвною рідиною.[1]
| Структурна формула | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
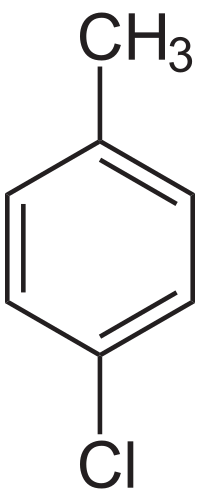
| ||||||||||||||||
| Загальна інформація | ||||||||||||||||
| Преференційна назва ІЮПАК | 4-хлоро-1-метилбензен | |||||||||||||||
| Систематична назва ІЮПАК | 4-хлоро-1-метилбензен | |||||||||||||||
| Хімічна формула | С7H7Cl | |||||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | |||||||||||||||
| Зовнішні ідентифікатори / Бази даних | ||||||||||||||||
| ||||||||||||||||
| Властивості | ||||||||||||||||
| Молярна маса | 126,59 г/моль [1] | |||||||||||||||
| Агрегатний стан |
Рідина (20 °C) [1] | |||||||||||||||
| Густина |
1,07 г/см3 (20 °C) [1] | |||||||||||||||
| Температура плавлення |
7,5 °C [1] | |||||||||||||||
| Температура кипіння |
162 °C [1] | |||||||||||||||
| Температура самозаймання |
570 °C [1] | |||||||||||||||
| Тиск насиченої пари |
3,6 hPa (20 °C) [1] | |||||||||||||||
| Безпека | ||||||||||||||||
| Маркування згідно системі УГС
Увага | ||||||||||||||||
| H-фрази | H: H226, H317, H332, H411 | |||||||||||||||
| P-фрази | P: P210, P233, P273, P280, P303+P361+P353, P304+P340+P312 | |||||||||||||||
| EUH-фрази | EUH: Заходи безпеки відсутні | |||||||||||||||
| LD50 |
2100 мг/кг (орально, пацюк) [1] | |||||||||||||||
| Вибухонебезпечність | ||||||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | ||||||||||||||||
Отримання
ред.2-хлоротолуен отримують хлоруванням толуену. При цьому утворюється суміш 2-хлоротолуену та 4-хлоротолуену, яку розділяють за допомогою дистиляції.[2]
Хімічні властивості
ред.Заміщення в ароматичному кільці
ред.4-хлоротолуен може брати участь у реакціях електрофільного ароматичного заміщення. Переважно, замісник опиняється в положенні 2, але інші ізомери також утворюються.[2]
Реакції метильної групи
ред.При вільнорадикальному хлоруванні атоми гідрогену метильної групи можуть бути заміщені на атоми хлору:[2]
При окисненні метильної групи утворюється 4-хлоробензойна кислота.
Заміщення атома хлору
ред.Хлоротолуен може гідролізуватися при взаємодії з основою за температури 350―400 °C і тиску 30 мПа.[2]
У присутності благородних металів можливе відновлення до толуену.[2]
Примітки
ред.- ↑ а б в г д е ж и к л GESTIS Substance Database. gestis-database.dguv.de. Архів оригіналу за 19 квітня 2022. Процитовано 19 квітня 2022.
- ↑ а б в г д Beck, Uwe; Löser, Eckhard (15 жовтня 2011). Wiley-VCH Verlag GmbH & Co. KGaA (ред.). Chlorinated Benzenes and Other Nucleus-Chlorinated Aromatic Hydrocarbons. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. o06_o03. doi:10.1002/14356007.o06_o03. ISBN 978-3-527-30673-2. Архів оригіналу за 17 квітня 2022. Процитовано 19 квітня 2022.



